青蒿素
 | |
 | |
| 臨床資料 | |
|---|---|
| 其他名稱 | Artemisinine, Qinghaosu |
| 给药途径 | 口服、栓剂 |
| ATC碼 | |
| 识别信息 | |
| |
| CAS号 | 63968-64-9 |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.110.458 |
| 化学信息 | |
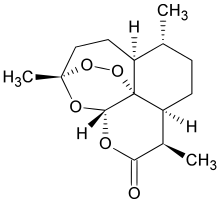
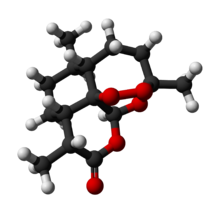
| 化学式 | C15H22O5 |
| 摩尔质量 | 282.332 g/mol |
| 3D模型(JSmol) | |
| 密度 | 1.24 ± 0.1 g/cm3 |
| 熔点 | 152至157 °C(306至315 °F) |
| 沸点 | 分解 |
| |
| |
青蒿素(英語:artemisinin;也称黄花蒿素)及其衍生物是现今所有药物中起效最快的抗恶性疟原虫疟疾药。[1] 使用包含青蒿素衍生物在内的青蒿素联合疗法是现今全球范围内治疗恶性疟原虫疟疾的标准方法。青蒿素提取自黄花蒿,1969年-1972年间,中国科学家屠呦呦參與的523课题组发现并从黄花蒿中提取了青蒿素[2],屠呦呦也因此获得2011年拉斯克临床医学奖[3]和2015年诺贝尔医学奖[4]。
化学上,青蒿素是少见的一种含有过氧桥的倍半萜内酯类化合物。普遍认为这种过氧化结构与青蒿素的抗疟活性有关。已知其他多种天然来源的含有过氧桥的化合物。[5]
世界卫生组织明确指出不要单独使用青蒿素进行治疗[6],因为有研究指出这会增加疟原虫的耐药性。已证明使用包括青蒿素在内的多藥联合疗法治疗疟疾同时具有很好的效果和耐受性。使用青蒿素来治疗间日疟原虫疟疾也越来越普遍,并且使用其来治疗癌症也是近来研究的课题之一。[7]
医疗用途[编辑]
单纯性疟疾[编辑]
单独青蒿素治疗疟疾使用会导致疟原虫复发,需要与其他药物配合使用清除寄生虫。 世界卫生组织正向制药商施压,使其停止向市场供应纯青蒿素,以免疟原虫对青蒿素产生抗药性[8]。
蠕虫寄生虫[编辑]
作用机制[编辑]
青蒿素无论在体内和体外的实验中均对疟疾有很好的杀灭效果。[9]
青蒿素的作用机制尚不十分清楚,主要是干扰疟原虫的表膜-线粒体功能。青蒿素通过影响疟原虫红内期的超微结构,使其膜系结构发生变化。由于对食物泡膜的作用,阻断了疟原虫的营养摄取,当疟原虫损失大量胞浆和营养物质,而又得不到补充,因而很快死亡。其作用方式是通过其内过氧化物(双氧)桥,经血红蛋白分解后产生的游离铁所介导,产生不稳定的有机自由基及/或其他亲电子的中介物,然后与疟原虫的蛋白质形成共价加合物,而使疟原虫死亡。[10] 2015年,Wang等人利用化学蛋白质组学的技术手段合成了基于青蒿素结构的化学探针,准确的鉴定出了青蒿素在疟原虫中的100多个蛋白靶点,并且确定了青蒿素的激活依赖于疟原虫中生成的大量血红素。[11]
自由基的抗疟作用[编辑]
青蒿素及其衍生物化学结构中的过氧桥这一基团是抗疟作用中最重要的结构。改变过氧基团,青蒿素的抗疟作用消失。青蒿素在体内活化后产生自由基,继而氧化性自由基与疟原虫蛋白质中的活性残基(例如半胱氨酸残基中的巯基)形成共价键,使蛋白失去功能导致疟原虫死亡。另一种观点认为青蒿素转化为碳自由基发挥烷化作用使疟原虫的蛋白烷基化。目前这一观点被广泛认可。[9]
对红内期疟原虫的直接杀灭作用[编辑]
青蒿素选择性杀灭红内期疟原虫是通过影响表膜-线粒体的功能,阻断宿主红细胞为其提供营养,从而达到抗疟的目的。同时青蒿素对疟原虫配子体具有杀灭作用。[9]
抑制 PfATP6 酶的抗疟作用[编辑]
有研究推测青蒿素及其衍生物对 PfATP6(Plasmodium falciparumcalcium ATPase 6)具有强大而特异的抑制效果。PfATP6 是恶性疟原虫基因组中唯一一类肌浆网/内质网钙ATP酶(sarco/endoplasmic reticulum calcium ATPase,SERCA)。青蒿素抑制 PfATP6,使疟原虫胞浆内钙离子浓度升高,引起细胞凋亡,从而发挥抗疟作用。[9]
耐药性[编辑]
有报道称早在2003年和2004年,首例以青蒿素为基础的综合疗法的耐药性案例就在泰国柬埔寨边界出现。2005年以来,治疗疟疾最有效的药物青蒿素已在柬埔寨、缅甸、越南、老挝以及泰国边境地区的越来越多患者中失效。[9]
不良反应[编辑]
少数部分病人可能会出现轻度恶心、呕吐、腹泻,存在胚胎毒性,孕妇慎用。
性质[编辑]


物理性质[编辑]
青蒿素在常温下是一种无色针状晶体,密度1.3g/cm3,比旋光度+68°(C=1.6,溶剂氯仿),几乎不溶于水,易溶于氯仿、乙酸乙酯和苯;常压下熔点156℃-157℃。青蒿素属于正交晶系,空间群D2-P212121,晶胞参数a = 24Å b= 9.4Å c= 6.3Å。其红外光谱具有δ-内酯羰基的吸收(1745cm-1)和过氧键的吸收(831、881、1115cm-1);其质谱具有质荷比为250的峰,对应的物种为分子脱去过氧桥后形成的分子离子。[12][13][14]
化学性质[编辑]
青蒿素是一种内酯,因而可以与盐酸羟胺发生反应,产物遇铁离子显色。虽然青蒿素含有过氧键,但相较于其他的过氧化物,青蒿素化学性质较为稳定,加热到熔点仍不分解。青蒿素可被三苯膦或碘离子定量地还原,这一反应可用于定量分析。在常压和钯-碳酸钙催化下,青蒿素的过氧键可被氢气还原,生成氢化青蒿素(C15H22O4)。以硼氢化钠处理青蒿素,则内酯的羰基被还原,生成半缩醛还原青蒿素(C15H24O5)。[12][13][15]
室温下以碳酸钾甲醇溶液处理青蒿素一小时,酸化后可以得到一种含有环氧基团的五元环内酯(C15H20O4);以硫酸-乙酸处理青蒿素可以得到另一种五元环内酯(C14H20O3)。[12]
制法[编辑]
青蒿素在黄花蒿中的生物合成[编辑]

黄花蒿分布地域狭窄,青蒿素含量偏低(0.01%~0.5%),中国以外地区野生黄花蒿因青蒿素含量太低而没有商业开发价值。
全合成[编辑]
1982年,羅氏公司的研究员G.Schmid和W.Hofheinz以薄荷醇为原料首次完成了青蒿素全合成。稍后,上海有机所的周维善等人以香草醛为原料完成了这一全合成。至2003年已有十余种青蒿素全合成路线。这些路线的起始物包括薄荷酮、3-蒈烯和环己烯酮。[16][17][18][19]

从逆合成分析的角度看,青蒿素的一个特点是它的结构中含有一个1,2,4-三噁唑环。该环实际上是一个缩酮-缩醛-内酯体系的一部分,可以由上图中α-过氧羟基醛(A)经缩合反应构建。过氧羟基醛(A)又可以由醛(B)的烯醇醚或类似化合物经过氧化反应获得。过氧化是青蒿素合成中的关键步骤,尽管不同的路线采用不同的方法引入过氧基团,这步反应产率总是比较低。[18][19][20]
Schmid等人、Ravindranathan等人、Lansbury等人、周维善等人利用烯醇醚在低温、光照和光敏剂存在下与单线态的氧分子发生的[2+2]环加成反应产生四员环中间体,然后开环形成过氧化物;Avery等人则利用烯基硅烷的反常臭氧化反应引入过氧基团。用酸处理过氧化产物就可以得到青蒿素。[18][21]

1989年,Nancy Acton等人发现,在低温和光照下,二氢青蒿酸可以被两当量的氧气直接氧化成青蒿素,产率17%-32%。后续研究表明在反应中,二氢青蒿酸先与一分子单线态氧发生烯反应,生成过氧化物。再与另一分子三线态氧反应,开环生成α-过氧羟基醛(A),最后脱水产生青蒿素。不久这一反应就被用于改进青蒿素的全合成路线。[18][22][23][24][25]化学合成青蒿素工艺繁杂,步骤多,成本高,易污染,尤其引入过氧基团的光氧化或化学氧化的产率不理想,导致化学全合成工艺一直无法用于青蒿素的商业化生产。
微生物工程菌全合成青蒿酸[编辑]
黄花蒿与酵母合成萜类前体法呢基焦磷酸的酶促反应完全相同,只要在酵母中增加一个代谢支路就能让酵母菌合成青蒿素。2006年,美国加州大学的Keasling小组将ADS 基因连同新克隆的细胞色素P450 单氧化酶基因(CYP71AV1)及其还原酶基因(CPR)同时导入酿酒酵母中表达,培育出世界上第一株生产青蒿酸的酵母工程菌。加拿大植物生物技术研究所的Covello小组于2008 年从黄花蒿中分离到双键还原酶基因(DBR2),并将该基因连同ADS、CYP71AV1、CPR 基因一起导入酿酒酵母,率先培育出能合成双氢青蒿酸的酵母工程菌。
酵母工程菌中未检测到青蒿素的原因可能有两个:一是酿酒酵母中单线态氧缺乏,双氢青蒿酸合成后不能转变成青蒿素;二是青蒿素未被油相环境隔离而与细胞成分(如血红素)发生烷基化反应,无法检测到青蒿素。黄花蒿是如何避免青蒿素对本身的伤害呢? Covello小组的研究显示,青蒿素合成酶基因在黄花蒿叶片表面具有特殊腺体结构并充满挥发油的腺状毛囊细胞中高效表达,说明具有毒性的青蒿素隔离在油相腺毛中应该是一种进化的选择。黄花蒿采取细胞分区和分相隔离的方式,合成并贮存具有细胞毒性的青蒿素,可用来杀灭猎食性害虫;同时青蒿素前体在油相环境中更易发生化学催化反应。据测定,青蒿植株中的青蒿素含量比双氢青蒿酸含量低5-10倍,最大可相差15倍。
2013年4月25日出版的Nature杂志发表了美国Keasling小组和加拿大Covello小组的两国科学家撰写的研究通信《强效抗疟剂青蒿素的高水平半合成生产》一文,报道了将酵母工程菌中青蒿素前体青蒿酸的发酵产量从1.6克/升提高到25克/升,并利用单线态氧成功地将青蒿酸转化成青蒿素。
发现历史[编辑]

20世纪60年代,越南战争时期,越南民主共和国(北越)军队受到疟疾困扰。为此,北越向中国求援。于是,时任中国共产党中央委员会主席的毛泽东和国务院总理的周恩来向中国大陆的顶级科学家下令,要求他们帮助研发相关药物。当时,中国的形势因为文化大革命的开展正开始逐渐失控,但是,由于命令来自毛泽东本人,该项目得以进行。1967年5月23日,「疟疾防治药物研究工作协作会议」召开,代号为523项目的抗疟药物研究正式工作开展。在接下来14年中,来自60所军民机构的500位科学家参与了此项目。[26][27]

1969年1月21日,全国523办公室白冰秋、张剑方二位正、副主任及办公室田辛到卫生部中医研究院中药研究所(简称北京中药所),要求其派人参加523项目北京地区中草药专业协作组。1970年,北京地区523领导小组讨论决定,由军事医学科学院和北京中药所合作,派军事医学科学院研究人员顾国明和北京中药所的余亚纲、屠呦呦等人一起,大量查阅和收集了古今医药书刊资料,从中挑选了出现频率较高的抗疟中草药或方剂。1971年后,顾国明因其他任务回原单位,由军事医学科学院微生物流行病研究所派研究人员宁殿玺到北京中药所帮助建立了鼠疟动物实验模型。1970年该组先制备的是胡椒提取物(胡椒酮),送军事医学科学院鼠疟筛选,动物实验效果不错,由523办公室联系,并派人请北京海淀青龙桥中药厂协助加工剂型,到海南岛进行临床试验,后因人体效果不理想而中止。该组从2000余种中药中筛选出640余种可能具有抗疟活性的药方,并以这些药方所涉的200余种植物制成380余种提取物。通过检验这些提取物对患疟疾小鼠的作用发现常山提取物抗疟作用最强,而青蒿提取物的实验结果有一定的抗疟作用,曾出现过对鼠疟原虫有60%-80%的抑制率,但不稳定(因为是高温醇提法,沸点78.4摄氏度)。在山东中医药研究所、云南省药物研究所的帮助下,研究人员发现药用青蒿中,学名黄花蒿(Artemisia annua)者有效,而学名青蒿(Artemisia apiacea)者无效;而且提取温度过高会破坏其中的活性成分。1971年下半年,屠呦呦领导的科研小组(包括钟裕蓉、郎林福等)从东晋葛洪《肘后备急方之治寒热诸疟方》中“青蒿一握,以水二升漬,绞取汁,尽服之”的记载中受到了启发,认为温度高有可能对青蒿有效成分造成破坏而影响疗效,便由用乙醇提取改为用沸点比乙醇低的乙醚提取。1971年10月4日研究组取得青蒿中性提取物对鼠疟、猴疟100%疟原虫抑制率的突破:
- 用北京青蒿秋季采的成株叶制成水煎浸膏,95%乙醇浸膏,挥发油对鼠疟均无效。
- 乙醇冷浸,浓缩时温度控制在60度所得提取物,鼠疟效价提高,温度过高则仍无效。
- 乙醚回流或冷浸所得提取物,鼠疟效价显著增高稳定。(低沸点乙醚(34.8度),并将温度控制在60度以下)
后来采用沸点更低(30-20.5度)的汽油提取法成功提取高质量青蒿素,印证了青蒿提取物的抗疟效果与温度有着非常重要的关系。1971年下半年北京中药所对青蒿乙醚提取物对鼠疟原虫近期抑制率达100%。
1972年3月的全国523会议上中医研究院屠呦呦做了青蒿提取物的报告后,山东省寄生虫病防治研究所采用本省黄花蒿的提取物进行鼠疟试验,于1972年10月21日在向全国523办公室作了书面报告一切和屠呦呦的结果一致。
1972年,在全国523办公室的支持和协调下,北京中药所经进一步实验,屠呦呦科研组的倪慕云设计了色谱柱分离的前处理,将青蒿乙醚提取物中性部分和聚酰胺混匀后,用47%乙醇渗滤,渗滤液浓缩后用乙醚提取浓缩后,编为91号,抗鼠疟作用大幅度提高。在经过动物毒性试验和少数健康志愿者试服,未发现明显毒副作用后,经全国523办公室协调安排,于1972年8~10月到海南岛昌江地区进行临床试验;又与解放军302医院合作,在北京也进行临床疗效观察。经过共30例临床试用,取得了比较满意的结果:
“1972年8-10月采用乙醚提取中性部分在昌江地区(海南)对当地外来人口间日疟11例、恶性疟9例、混合感染1例及北京302医院验证间日疟9例,共30例进行了临床观察。三种剂量均有效,其中大剂量组(每日4次,每次3克,共36克)疗效更明显。对间日疟平均退热时间19小时6分,对外来人口恶性疟平均退热时间35小时59分,但短期内有原虫复现。由于药物体积较大,无法再加大剂量进行观察,但发现大剂量组原虫复现较小剂量组有所减少。临床观察药物对胃肠道、肝、肾功能等未见明显副作用,个别病人出现呕吐、腹泻现象,302医院2例转氨酶偏高病人服药后转氨酶继续增高,但1-2周左右恢复正常。”
在粗提物临床观察的同时,根据523办公室要求,北京中药所开展了青蒿素抗疟有效单体的分离研究。1972年11月8日,屠呦呦领导的研究组从乙醚提取物中用色谱法分离提取出了多个单体成分,其中1个有抗疟效果的无色晶体提取物定名为“青蒿素II”,并测定了熔点和分子量。1972年11月17日屠呦呦在北京召开的“523”全体大会上,报告了首次青蒿抗疟30例全部有效的疗效总结,引起523项目参与单位的极大关注。北京中药所按照全国523办公室指定的1973年研究计划的要求,为了将分离的到的“青蒿素II”,尽快拿到现场进行临床试用观察,开展了临床前动物毒性试验,发现“青蒿素II”对实验动物的心脏有明显的毒性。因此,围绕着“青蒿素Ⅱ”能否进行临床试用产生了分歧。为此,北京中药所领导和专家多次研究,全国523办公室的领导听取了该所的汇报后,经该所的3名科技人员试服,每天口服1次,连服3天,3人的总剂量分别是3.5g、5g、5g。经心电图、脑电图、肝功能、肾功能、胸透和血常规、尿常规检查,均无明显变化。其中1人出现四肢发麻感,12h后消失;1人心跳加速(112次/min),30min后恢复正常。北京中药所领导同意“青蒿素Ⅱ”进行临床试验。
1972年,在印度新德里召开的第八届国际天然产物化学会议上,南斯拉夫植物化学家宣读了一份研究报告,称他们从蒿属植物中分离出一种新型倍半萜内酯,分子式为C15H22O5,分子量是282,与青蒿素结果相同。南斯拉夫科学家虽然搞对了分子式和分子量,但却排错了化学结构,误以为是双氢青蒿素的臭氧化物。该文献见:[28]
1973年3月,北京中医研究院中药研究所的科技人员找到上海有机所,[29]以测定青蒿素结晶的分子结构。经全国523办公室协调,由山东省中医药研究所提供了10多克黄花蒿素。上海有机所避孕药组的吴照华专职带着北京中医研究院中药研究所的倪慕云和后来的刘静明、樊菊芬在实验室进行工作。青蒿素结构测定中的一个主要困难是无法在15个碳骨架中安排5个氧原子,当时参加的人员都曾经考虑过这可能是一个过氧化合物,但是过氧化合物不稳定的传统概念又否定了这一想法。当时全国本来没有质谱仪,唯一一套还是北京某机关1974年刚刚引进的。赴京申请到高分辨质谱仪做实验确定了分子量,再结合碳氢分析数据把分子式确定下来,这是一个有15个碳原子、22个氢原子和5个氧原子组成的化合物,证明它是一个倍半萜类化合物。 在质谱的分析中,他们发现一个特殊的碎片峰M-32,这明显说明分子中存在两个氧原子连在一起的情况。1975年4月下旬,在成都召开的全国“五二三项目”座谈会上,北京医学科学院药物研究所于德泉报告了另一种抗疟药鹰爪素是一个过氧化合物。吴毓林获悉这一消息后,立即在吴照华的实验室用青蒿素做了一个碘化钠的定性试验,明确了过氧基团的存在。在此基础上,又用三苯膦的方法作了过氧基团的定量分析,进一步确证了青蒿素是一过氧化合物。根据青蒿素的波谱数据得出了青蒿素的片段结构,如内酯、3个甲基、4个次甲基等;根据南斯拉夫Stefanovic从同一植物中分得的青蒿素B(arteannuin B)的结构,提出其与青蒿素结构可能有相似性;从当时已收集了青蒿素单晶X-衍射的数据,正要进行计算的中科院生物物理所,提出了一个青蒿素初步结构作为他们计算时参考。最终1975年的12月生物物理所由单晶X-衍射得到了青蒿素的相对构型,根据青蒿素B的结构则可推测得绝对构型;1979年还是由生物物理所通过反常的X-衍射分析最终肯定了青蒿素的绝对构型。
1973年4月,云南省药物研究所用乙醚提取分离直接得到有效单体,在1973年10月完成鼠疟与猴疟动物实验,定名为“苦蒿结晶III”(后称“黄蒿素”)。1974年初,云南药物研究所用重结晶法得到纯结晶。
1973年11月,山东省中医药研究所从山东省当地的黄花蒿提取出有效单体,命名为“黄花蒿素”。
1973年9-10月,由中医研究院李传杰为组长的临床试验组,再次到海南岛昌江地区石碌进行“青蒿素Ⅱ”临床试验。[30][31][19]全国523办公室施凛荣和上海523办公室副主任王连柱到海南现场工作,也到昌江了解的试用情况。该组在海南岛昌江县收治外来人口间日疟和恶性疟病人8例:间日疟3例有效,恶性疟5例未显示明显疗效,其中1例虽即时有效,但6天内复发,2例无效,另2例因出现心脏毒性反应而终止了临床试验。
1974年2月28号-3月1号,正在进行青蒿/黄花蒿抗疟研究的北京、山东、云南三地四家单位(北京中药所、云南药物所、山东寄生虫防治所、山东中医研究所)的科研人员与全国523办公室在北京中医研究院召开了青蒿研究座谈会,三个地区的研究人员各自汇报了青蒿(黄花蒿)研究进展。北京中药所的景厚德提出三地的提取到的晶体之间的不同之处:
- 山东25mg/kg有效,北京100mg/kg有效;
- C=O基分化,山东、云南差80;
- 熔点不同,山东:150~151℃,云南:149~150.5℃,北京155~156℃(屠呦呦报告的是156~157℃)
- 毒性:北京的提取物对心脏毒性200mg/kg;后来山东和云南的临床验证结果都未显示有明显的心脏毒性
景厚德根据以上四点不一样提出三家提取到的结晶可能不用完全一样。
1975年6月,北京中药所重新开展青蒿素的临床研究,与湖北健民制药厂合作,用四川酉阳黄花蒿、云南溶剂汽油法提取青蒿素(黄花蒿素),分别在海南或与湖北医科院、武钢和河南等单位合作进行的。
1975年,上海有机化学所在化学结构的测定研究中,为证明青蒿素是一个过氧化物,进行氢化—还原等实验,确定了青蒿素的内酯可被钠(钾)硼氢还原,并保留其过氧基团。该还原物称为“还原青蒿素”或“二氢青蒿素”,后命名为“双氢青蒿素”。它是制备青蒿素衍生物的重要中间体。1978年,上海药物所在青蒿素衍生物的研究中,发现其抗疟效果比青蒿素更好。由于化学稳定性较差、溶解度低、抗疟效果不及其他衍生物,当时尚未被列为进一步开发的对象。
1976年523办公室获悉南斯拉夫科学家正在分离蒿属植物的类似物质,估计就是正在研究的青蒿素。为了抢先发表论文,表明青蒿素是中国的原创发明,卫生部直属的北京中医研究院中药研究所请示,经国家卫生部批准,在1977年《科学通报》第22卷第3期以“青蒿素结构研究协作组”的名义,首次发表了青蒿素化学结构及相对构型的论文,题目是《一种新型的倍半萜内酯——青蒿素》。青蒿素的结构完全公诸于世。
1978年11月23-29日,全国523领导小组在江苏省扬州市(高邮县所在地区行署所在地)主持召开了青蒿素(黄蒿素)治疗疟疾科研成果鉴定会,就成果排名达成一致,它们是以下6个单位:卫生部中医研究院、山东省中医药研究所、云南省药物研究所、广州中医学院(以上为青蒿素研究单位)、四川省中药研究所、江苏省高邮县卫生局(以上为青蒿简易制剂研究单位)。另外,中国科学院生物物理研究所、中国科学院上海有机化学研究所等39个单位被确定为主要协作单位。最后通过的《青蒿素鉴定书》对于4个青蒿素研究单位的评语是:“1971年10月,中医研究院中药研究所从中药青蒿(黄花蒿)中找到了抗疟有效部分。1972年和1973年中医研究院中药研究所、山东省中医药研究所和云南省药物研究所,先后分离出有效单体青蒿素(黄花蒿素、黄蒿素)。1974年广州中医学院和云南省药物研究所在临床上成功地运用青蒿素救治了恶性疟和脑型疟。”1978年12月28日国务院发布《发明奖励条例》后,上述6个青蒿素及青蒿制剂研究单位共同向国家科委申报了青蒿素发明奖。评审委员会认为,青蒿素作为新药发明,结构分析必不可少,提出将中国科学院生物物理研究所和中国科学院上海有机化学研究所列为主要研究单位。同时认为,四川省中药研究所和江苏省高邮县卫生局的成果分别是青蒿生药片和青蒿生药简易制剂,应列为主要协作单位。因此,1979年9月由国家科委主任方毅颁发的“抗疟新药——青蒿素”(二等奖)发明证书(A00011)中仅列出6个主要研究单位——卫生部中医研究院中药研究所、山东省中医药研究所、云南省药物研究所、中国科学院生物物理所、中国科学院上海有机化学所、广州中医学院。
由于涉密,1979年这些研究成果才陆续发表,以“青蒿素结构研究协作组”和中国科学院生物物理研究所名义在《中国科学》1979年第11期发表的《青蒿素的晶体结构及其绝对构型》的论文[30][31][19]以刘静明、倪慕云、樊菊芬、屠呦呦(北京中医研究院中药研究所)和吴照华、吴毓林、周维善(中国科学院上海有机化学所)联名发表在《化学学报》1979年第37卷第2期上的《青蒿素(Artemisinin)的结构和反应》的论文,明确写道:“这个新型的倍半萜内酯我们称其为青蒿素,它经药理证明是抗疟的有效成分”。1979年在英文版《中华医学杂志》(Chinese Medicine Journal)以“青蒿素研究协作组”(Qinghaosu Antimalarial Coordinating Research Group)名义发表的《青蒿素的抗疟作用研究》(Antimalarial studies on qinghaosu)论文,更是公开了实验研究和临床研究的化学及药理学数据。
1980年12月5日,时任WHO总干事的哈夫丹·马勒致函中国卫生部称,鉴于氯喹抗性疟的蔓延己达到不可遏制的地步,WHO迫切希望尽快在中国召开一次青蒿素及其衍生物的学术研讨会。由WHO的疟疾化疗学术工作组(SWG-CHEMAL)主持的青蒿素及其衍生物学术研讨会,于1981年10月6日至10日在北京召开,宣读的7份研究报告,全部由中方科学家完成。1982年3月20日,国家卫生部、国家医药管理总局联合成立“中国青蒿素及其衍生物研究开发指导委员会”(简称青蒿素指导委员会),计划在两年内按照国际标准完成青蒿素(口服)、蒿甲醚、青蒿琥酯(针剂)制剂的质控标准、临床前药理毒性实验资料和临床I、II 、III期等6项课题的研究工作,WHO则向中方提供人员培训、仪器设备和必要的纯种实验动物等。。
青蒿素的第一个新药证书于1986年由卫生部颁发给中国中医研究院中药研究所,编号为(86)卫药证字X-01号。
1987年,由桂林制药厂、上海医药工业研究院、军事医学科学院微生物流行病研究所、中国中医研究院中药研究所、中国医学科学院药物研究所、中国科学院上海药物研究所、广西医学院、广西中医学院研制的青蒿琥酯获得新药证书,编号为(87)卫药证字X-01号。2002年,青蒿琥酯片剂被世界卫生组织(WHO)列入第12版“基本药物目录”。
1987年,中国科学院上海药物研究所和昆明制药厂研制的蒿甲醚及其注射液获得新药证书,编号分别为(87)卫药证字X-13和(87)卫药证字X-14号。1997年,蒿甲醚油针剂被WHO列入第9版“基本药物目录”。
1989年12月,“抗疟新药——青蒿琥酯”获得国家发明三等奖(A03611),发明人包括8个单位(桂林制药厂、广西医学院、广西寄生虫病研究所、广州中医学院、上海医药工业研究所、军事医科院五所、医学科学院药物所、中医研究院中药所)和8个个人(刘旭、杨启超、石维志、李国桥、王大林、滕翕和、宋振玉、李泽霖)。
军事医学科学院以本芴醇与蒿甲醚研制的复方蒿甲醚于1992年获得新药证书,编号是(92)卫药证字X-23号。复方蒿甲醚于2002年被WHO列入第12版“基本药物目录”。
从1985年中国开始实行新药评审规定到1995年,总共批准一类新药14个,其中青蒿素及其衍生物类抗疟新药就占了7个。
1996年12月,中国科学院上海药物研究所的“抗疟新药——蒿甲醚”发明获得国家发明三等奖(15-3-001-01)。
衍生物[编辑]
参见[编辑]
参考文献[编辑]
- ^ White NJ. Assessment of the pharmacodynamic properties of antimalarial drugs in vivo. Antimicrob. Agents Chemother. July 1997, 41 (7): 1413–22. PMC 163932
 . PMID 9210658.
. PMID 9210658.
- ^ 米勒·路易斯(Louis H. Miller)和苏新专(Xin-zhuan Su). 青蒿素:源自中草药园的发现. 《细胞》 (CAMBRIDGE, MA 02139, USA: Cell Press). 2011-09-16, 146 (6): 855–858 [2011-09-26]. ISSN 0092-8674. PMID 21907397. doi:10.1016/j.cell.2011.08.024. (原始内容存档于2011-09-24).
- ^ 屠呦呦获2011年拉斯克奖. 科学网. 2011-09-12 [2011-09-13]. (原始内容存档于2011-09-23).
- ^ The Nobel Prize in Physiology or Medicine 2015 (页面存档备份,存于互联网档案馆) - Nobel Prize
- ^ Royal Society of Chemistry. Artemisinin and a new generation of antimalarial drugs. Education in Chemistry. July 2006 [2015-10-06]. (原始内容存档于2015-10-06).
- ^ WHO calls for an immediate halt to provision of single-drug artemisinin malaria pills. WHO. 19 January 2006 [2015-10-06]. (原始内容存档于2021-03-08).
- ^ Douglas NM, Anstey NM, Angus BJ, Nosten F, Price RN. Artemisinin combination therapy for vivax malaria. Lancet Infect Dis. June 2010, 10 (6): 405–16. PMC 3350863
 . PMID 20510281. doi:10.1016/S1473-3099(10)70079-7.
. PMID 20510281. doi:10.1016/S1473-3099(10)70079-7.
- ^ Rehwagen C. WHO ultimatum on artemisinin monotherapy is showing results. BMJ. May 2006, 332 (7551): 1176. PMC 1463909
 . PMID 16709988. doi:10.1136/bmj.332.7551.1176-b.
. PMID 16709988. doi:10.1136/bmj.332.7551.1176-b.
- ^ 9.0 9.1 9.2 9.3 9.4 2015 诺贝尔生理学或医学奖:青蒿素与疟疾. [6 October 2015]. (原始内容存档于2015-11-10).
- ^ 青蒿素栓_化生药说明书_临床用药参考. [6 October 2015]. (原始内容存档于2019-09-04).
- ^ Wang J, Zhang CJ, Chia WN, Loh CC, Li Z, Lee YM, He Y, Yuan LX, Lim TK, Liu M, Liew CX, Lee YQ, Zhang J, Lu N, Lim CT, Hua ZC, Liu B, Shen HM, Tan KS, Lin Q. Haem-activated promiscuous targeting of artemisinin in Plasmodium falciparum. Nature Communications. 2015, 6: 10111. PMC 4703832
 . PMID 26694030. doi:10.1038/ncomms10111.
. PMID 26694030. doi:10.1038/ncomms10111.
- ^ 12.0 12.1 12.2 刘静明 倪慕云 樊菊芬 屠呦呦 吴照华 吴毓林 周维善. 青篙素 (Arteannuin) 的结构和反应. 化学学报. 1979年6月.
- ^ 13.0 13.1 青蒿素结构研究协作组. 一种新型的倍半萜内酯——青蒿素. 化学通讯. 1976年.
- ^ 王宗德 孙芳华. 青蒿素理化性质及其测定方法的研究进展. 江西农业大学学报. 1999年.
- ^ 李英 虞佩琳 陈一心 李良泉 盖元珠 王德生 郑亚平. 青篙素衍生物的合成. 化学学报. 1979年5月.
- ^ G.Schmid,W.Hofheinz. Total Synthesis of Qinghaosu. J. Am. Chem. SOC. 1983年.[永久失效連結]
- ^ 许杏祥 朱杰 黄大中 周维善. 青富素及其-类物结构和合成的研究. 化学学报. 1984年第42期.
- ^ 18.0 18.1 18.2 18.3 周维善 许杏祥. Total Synthesis of the Antimalarial Sesquiterpene Peroxide Qinghaosu and Yingzhaosu A. Ace. Chem. Res. 1994年27期. [永久失效連結]
- ^ 19.0 19.1 19.2 19.3 吴毓林. 青蒿素———历史和现实的启示. 化学进展. 2009年11月.
- ^ B.E. Maryanoff,A.B. Reitz. Advances in Medicinal Chemistry. Elsevier. 1999: 128 [2015-10-07]. (原始内容存档于2020-09-17).
- ^ 金红霞 伍贻康. 有机过氧化物中过氧键的建立(引入)方法. 有机化学. 2005年.
- ^ Ronald J. Rotht,Nancy Acton. A SIMPLE CONVERSION OF ARTEMISINIC ACID INTO ARTEMISININ. Journal of Natural Produrts. 1989年.[永久失效連結]
- ^ Nancy Acton,Ronald J. Rotht. On the Conversion of Dihydroartemisinic Acid into Artemisinin. J. Org. Chem. 1992年第57期. [永久失效連結]
- ^ Liu Hsing-Jang, Yeh Wen-Lung, Yeu Chew Sew. A total synthesis of the antimarial natural product (+)-qinghaosu. Tetrahedron Letters. 1993年7月.
- ^ Mauricio Gomes Constantinoa, Milton Beltrame Jr.a, Gil Valdo José da Silvaa, Julio Zukerman-Schpectorb. A Novel Asymmetric Total Synthesis of (+)-Artemisinin. Taylor & Francis. 1996 [2015-10-07]. (原始内容存档于2022-06-15).
- ^ DONALD G. McNEIL Jr. For Intrigue, Malaria Drug Gets the Prize. 《纽约时报》. 2012-01-16 [2012-01-17]. (原始内容存档于2019-02-15) (英语).
- ^ 军事医学科学院总结60年抗疟历史再绘发展蓝图. 解放军军事医学科学院. 2011-09-26. (原始内容存档于2012-07-24) (中文(简体)).
- ^ Jeremic D, Jokic A, Stefanovic M. New Type of Sesquiterpenen Lactone isolated from Artemisia annua L.Ozonide of Dihydroarteannuin, presented at the 8th Int. Symp on Chemistry of Natural Products, New Delhi (1972) 222)。
- ^ 王丹红. 周维善院士等讲述青蒿素结构的测定与全合成经过. 科学时报. 2008-12-02 [2015-10-06]. (原始内容存档于2016-03-04).
- ^ 30.0 30.1 卢义钦. 青蒿素的发现与研究进展. 生命科学研究. 2012年6月.
- ^ 31.0 31.1 刘春朝 王玉春 欧阳藩 叶和春 李国风. 青蒿素研究进展. 化学进展. 1999年2月.
外部链接[编辑]
- 青蒿素 Artemisinin (页面存档备份,存于互联网档案馆) 中草藥化學圖像數據庫 (香港浸會大學中醫藥學院) (繁體中文)(英文)
- 青蒿 中藥材圖像數據庫 (香港浸會大學中醫藥學院) (中文)(英文)
- 黃花蒿 Huanghuahao (页面存档备份,存于互联网档案馆) 藥用植物圖像數據庫 (香港浸會大學中醫藥學院) (中文)(英文)
- 青蒿 Qinghao (页面存档备份,存于互联网档案馆) 藥用植物圖像數據庫 (香港浸會大學中醫藥學院) (中文)(英文)
- 青蒿素 (artemisinin) (页面存档备份,存于互联网档案馆) 化学空间 Chem-Station) (中文)(英文)
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
