一氧化鉛
| 一氧化鉛 | |
|---|---|

| |
| |
| IUPAC名 Lead(II) oxide | |
| 別名 | 密陀僧 黃丹 鉛黃 |
| 識別 | |
| CAS號 | 1317-36-8 |
| PubChem | 14827 |
| ChemSpider | 140169 |
| SMILES |
|
| UN編號 | 3288 2291 3077 |
| ChEBI | 81045 |
| RTECS | OG1750000 |
| KEGG | C17379 |
| 性質 | |
| 化學式 | PbO |
| 摩爾質量 | 223.20 g/mol g·mol⁻¹ |
| 外觀 | 紅色或黃色粉末 |
| 密度 | 9.53 g/cm3 |
| 熔點 | 888 °C(1161 K) |
| 沸點 | 1477 °C(1750 K) |
| 溶解性(水) | 0.017 g/L[1] |
| 溶解性 | 不溶於稀鹼,醇 溶於濃鹼 溶於鹽酸,氯化銨 |
| 磁化率 | 4.20×10−5 cm3/mol |
| 結構 | |
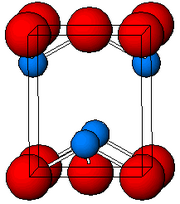
| 晶體結構 | 四方,tP4 |
| 空間群 | P4/nmm, No. 129 |
| 危險性 | |
GHS危險性符號  
| |
| GHS提示詞 | 危險 |
| H-術語 | H302, H332, H351, H360, H362, H373, H410 |
| P-術語 | P201, P202, P260, P261, P263, P264, P270, P271, P273, P281, P301+312, P304+312, P304+340, P308+313 |
| NFPA 704 | |
| 閃點 | 不可燃 |
| 致死量或濃度: | |
LDLo(最低)
|
1400 mg/kg(犬,經口)[2] |
| 相關物質 | |
| 其他陰離子 | 硫化鉛 硒化鉛 碲化鉛 |
| 其他陽離子 | 一氧化碳 一氧化硅 一氧化鍺 一氧化錫 |
| 相關鉛的氧化物 | 四氧化三鉛 二氧化鉛 |
| 相關化學品 | 三氧化二鉈 三氧化二鉍 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
一氧化鉛是一種無機化合物,化學式為PbO。它以兩種同質異形體存在:具有四方晶系結構的密陀僧和斜方晶系結構的黃丹。一氧化鉛在現代主要用於鉛基工業玻璃和工業陶瓷,包括計算機組件。它為兩性氧化物。[3]
一氧化鉛在唐代由波斯傳入中國,其俗稱「密陀僧」是波斯語古稱「مُرداسنگ」(Mardasang,波斯文又作 مُردارسنگ 或 مُرداسنج)的音譯,當時用作治療痔瘡的藥物。[4]
製備[編輯]
一氧化鉛可以通過在大約600 °C(1,100 °F)的空氣中加熱鉛來製備。在此溫度下,它也是空氣中其他鉛氧化物分解的最終產物:[5]
- 2 Pb(NO
3)
2 → 2 PbO + 4 NO
2 + O
2 - PbCO
3 → PbO + CO
2
一氧化鉛作為將鉛礦石精煉成金屬鉛的中間產品。通常的鉛礦石是方鉛礦(PbS2)。在大約1,000 °C(1,800 °F)的溫度下,硫化物將轉化為氧化物:[6]
- 2 PbS + 3 O
2 → 2 PbO + 2 SO
2
高純的一氧化鉛通常則以乙酸鉛為原料,用濃氨水處理後加熱分解得到。[7]
反應[編輯]
一氧化鉛的紅色和黃色形式與焓的微小變化有關:
- PbO(紅色) → PbO(黃色) ΔH = 1.6 kJ/mol
PbO 是兩性的,這意味着它會與酸和鹼反應。與酸作用會通過氧簇的中介作用形成Pb2+
的鹽,如[Pb
6O(OH)
6]4+
。與強鹼作用則會溶解形成亞鉛酸鹽:[8]
- PbO + H
2O + OH−
→ [Pb(OH)
3]−
用途[編輯]
鉛玻璃中的鉛通常是一氧化鉛,而一氧化鉛廣泛用於製造玻璃。根據玻璃的不同,在玻璃中使用一氧化鉛的好處可以是增加玻璃的折射率、降低玻璃的粘度、增加玻璃的電阻率和增加玻璃的吸收X射線能力中的一種或多種。在工業陶瓷(以及玻璃)中添加一氧化鉛可以使材料提高居里溫度,以此在磁性和電學上更具惰性。[9]歷史上,一氧化鉛也廣泛用於家用陶瓷的釉料,但現在不再廣泛使用。其他不太占主導地位的應用包括橡膠的硫化以及某些顏料和油漆的生產。[3]一氧化鉛可用於陰極射線管玻璃,以阻擋X射線發射,但主要用於頸部和漏斗,因為它在面板中使用時會導致變色。故面板優選氧化鍶和氧化鋇。[10]
鉛的消耗以及一氧化鉛的加工與汽車數量相關,因為它仍然是汽車中鉛酸電池的關鍵組成部分。[11]
少見或過時的用途[編輯]
一氧化鉛與甘油的混合物凝固成堅硬的防水水泥,用於連接水族箱的平板玻璃側面和底部,也曾用於密封窗框中的玻璃面板。它是含鉛油漆的成分。
一氧化鉛是傳統皮蛋的製作原料之一,但由於健康問題已被逐漸取代。
參考文獻[編輯]
- ^ Blei(II)-oxid[失效連結]. Merck
- ^ Lead compounds (as Pb). Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ 3.0 3.1 Carr, Dodd S., Lead Compounds, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a15_249
- ^ (美)愛德華·謝弗.《唐代的外來文明》
- ^ Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016: 382–387. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英語).
- ^ Abdel-Rehim, A. M. Thermal and XRD analysis of Egyptian galena. Journal of Thermal Analysis and Calorimetry. 2006, 86 (2): 393–401. S2CID 96393940. doi:10.1007/s10973-005-6785-6.
- ^ 朱文祥. 無機化合物製備手冊. 化學工業出版社,2006. pp581-582. 【XIV-368】氧化鉛 [Lead(II) oxide]
- ^ Holleman, Arnold Frederik; Wiberg, Egon, Wiberg, Nils , 編, Inorganic Chemistry, 由Eagleson, Mary; Brewer, William翻譯, San Diego/Berlin: Academic Press/De Gruyter, 2001, ISBN 0-12-352651-5[頁碼請求]
- ^ Chapter 9, "Lead Compounds", in the book Ceramic and Glass Materials: Structure, Properties and Processing (頁面存檔備份,存於網際網路檔案館), published by Springer, year 2008.
- ^ Compton, Kenneth. Image Performance in CRT Displays. SPIE Press. 5 December 2003 [2022-06-03]. ISBN 9780819441447. (原始內容存檔於2022-06-03) –透過Google Books.
- ^ Sutherland, Charles A.; Milner, Edward F.; Kerby, Robert C.; Teindl, Herbert; Melin, Albert; Bolt, Hermann M., Lead, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a15_193.pub2
- ^ Corson, B. B. (1936). "1,4-Diphenylbutadiene". Org. Synth. 16: 28; Coll. Vol. 2: 229.
外部連結[編輯]
- Case Studies in Environmental Medicine - Lead Toxicity (頁面存檔備份,存於網際網路檔案館)
- ToxFAQs: Lead (頁面存檔備份,存於網際網路檔案館)
- National Pollutant Inventory - Lead and Lead Compounds Fact Sheet
- Webelements PbO (頁面存檔備份,存於網際網路檔案館)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


![{\displaystyle {\ce {PbO2->[{293 °C}] Pb12O19 ->[{351 °C}] Pb12O17 ->[{375 °C}] Pb3O4 ->[{605 °C}] PbO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/65b5cadcc73921d39d6f69f4b6d59a4227e2b780)