冷卻浴

在有機化學中,冷卻浴(英語:cooling bath)是一種通過調配液態混合物的冷凍劑提供和維持低溫環境的實驗技術,冷卻浴所能提供的溫度範圍通常為13至-196℃。它常用於需要在低於室溫下進行的反應和實驗處理步驟,通常這些反應和處理操作是放熱的或是會涉及熱不穩定的中間體或產物。冷卻浴所用的冷卻劑包括乾冰、液氮 和碎冰塊。
產生和維持低溫的方法[編輯]
產生和維持低溫的方法主要有三種:冰鹽浴(ice-salt baths)[1][2]、乾冰-溶劑浴(dry ice-solvent baths)[3][4]和液氮-雪泥浴(liquid nitrogen slush baths)[5][6][7]。
| 溶劑 | 溫度(℃) | 溶劑 | 溫度(℃) |
|---|---|---|---|
| 對二甲苯 | 13±1[7] | 乙酸乙酯 | -84[7] |
| 1,4-二氧六環 | 12[7] | 正己基溴 | -85[7] |
| 環己烷 | 6[7] | 甲基乙基酮 | -86[7] |
| 苯 | 5[7] | 丙烯醛 | -88[7] |
| 甲酰胺 | 2[7] | 戊基溴 | -88[7] |
| 苯胺 | -6[7] | 正丁醇* | -89[7] |
| 乙二醇* | -10[7] | 叔丁醇* | -89[7] |
| 環庚烷 | -12[7] | 異丙醇* | -89[7] |
| 苯甲酸甲酯 | -12[7] | 硝基乙烷 | -90[7] |
| 苯甲腈 | -13[7] | 庚烷 | -91[7] |
| 苯甲醇 | -15[7] | 醋酸正丙酯 | -92[7] |
| 炔丙醇 | -17[7] | 2-硝基丙烷 | -93[7] |
| 鄰二氯苯 | -18[7] | 環戊烷 | -93[7] |
| 四氯乙烷 | -22[7] | 乙苯 | -94[7] |
| 四氯化碳 | -23[7] | 己烷 | -94[7] |
| 間二氯苯 | -25[7] | 甲苯 | -95[7] |
| 硝基乙烷 | -29[7] | 異丙苯 | -97[7] |
| 鄰二甲苯 | -29[7] | 甲醇 | -98[7] |
| 溴苯 | -30[7] | 乙酸甲酯 | -98[7] |
| 碘苯 | -31[7] | 乙酸異丁酯 | -99[7] |
| 間甲基苯胺 | -32[7] | 戊基溴 | -99[7] |
| 噻吩 | -38[7] | 丁醛 | -99[7] |
| 乙腈 | -41[7] | 丙基碘 | -101[7] |
| 吡啶 | -42[7] | 丁基碘 | -103[7] |
| 溴化苄 | -43[7] | 環己烷 | -104[7] |
| 環己基溴 | -44[7] | 叔丁基胺 | -105[7] |
| 氯苯 | -45[7] | 異辛烷 | -107[7] |
| 間二甲苯 | -47[7] | 1-硝基丙烷 | -108[7] |
| 正丁基胺 | -50[7] | 碘乙烷 | -109[7][8] |
| 乙酸苄酯 | -52[7] | 丙基溴 | -110[7] |
| 正辛烷 | -56[7] | 二硫化碳 | -110[7] |
| 氯仿 | -63[7] | 丁基溴 | -112[7] |
| 碘甲烷 | -66[7] | 乙醇* | -116[7] |
| 叔丁基胺 | -68[7] | 異戊醇* | -117[7] |
| 三氯乙烯 | -73[7] | 溴乙烷 | -119[7] |
| 乙酸異丙酯 | -73[7] | 氯丙烷 | -123[7] |
| 2-甲基異丙基苯 | -74[7] | 丁基氯 | -123[7] |
| 4-甲基異丙基苯 | -73[7] | 乙醛 | -124[7] |
| 乙酸丁酯 | -77[7] | 甲基環己烷 | -126[7] |
| 醋酸異戊酯 | -79[7] | 正丙醇* | -127[7] |
| 丙烯腈 | -82[7] | 正戊烷 | -131[7] |
| 正己基氯 | -83[7] | 1,5-己二烯 | -141[7] |
| 丙胺 | -83[7] | 異戊烷 | -160[7] |
液氮雪泥浴[編輯]
通過把液氮小心地加到不斷攪拌的某種有機溶劑中來調配呈雪糕狀的液氮雪泥浴,同時用玻璃棒攪拌能避免液氮雪泥浴局部固化。 液氮雪泥浴能實現的溫度範圍是從13至-196℃。一般在使用杜瓦瓶能達到較好保溫條件的情況下,液氮雪泥浴可維持數個小時。但如果反應需要維持更長時間的低溫比如需要過夜反應時,有必要使用制冷機、循環冷凝機或冰箱等機械製冷手段來維持長時間的低溫。液氮雪泥浴特別適用於給反應溶劑脫氣[8]和減壓蒸餾時餾分的冷凝收集。
冰鹽冷卻浴[編輯]
常壓下冰水混合物的溫度為0℃,將鹽的濃溶液與碎冰攪拌混合得到的由冰和鹽水構成的冷卻浴能產生並維持低於0℃的溫度效果。改變鹽溶液的濃度能調節冷卻浴能維持的穩態溫度,不同種類的鹽能實現的冷卻浴最低溫度也各不相同,實踐中能得到並維持的溫度範圍通常在0至-51℃之間(詳見下表)。但是當鹽溶液上升到一定濃度後,原先呈冰水混合物狀態的冰鹽冷卻浴會因達到共晶溫度(Eutectic temperature)而全部凝結形成顆粒狀的冰鹽粒子[1],這樣就使得浸沒在其中的實驗裝置接觸導熱面積變小,不利於熱量的及時擴散。
| 鹽 | 鹽溶液 (g無水鹽/100g水) |
溫度(℃) | 鹽 | 鹽溶液 (g無水鹽/100g水) |
溫度(℃) |
|---|---|---|---|---|---|
| NaCl | 6.11 | -3.48[1] | NH4Cl | 9.28 | -5.73[1] |
| NaCl | 8.93 | -5.17[1] | NH4Cl | 12.27 | -7.63[1] |
| NaCl | 10.77 | -6.32[1] | NH4Cl | 12.56 | -7.80[1] |
| NaCl | 14.20 | -8.52[1] | NH4Cl | 13.76 | -8.60[1] |
| NaCl | 15.46 | -9.41[1] | NH4Cl | 16.89 | -10.58[1] |
| NaCl | 17.87 | -11.04[1] | NH4Cl | 18.80 | -11.80[1] |
| NaCl | 22.25 | -14.33[1] | NH4Cl | 19.94 | -12.44[1] |
| NaCl | 22.99 | -14.77[1] | NH4Cl | 19.93 | -12.60[1] |
| NaCl | 24.75 | -16.21[1] | NH4Cl | 22.40 | -14.03[1] |
| NaCl | 27.70 | -18.73[1] | NH4Cl | 24.13 | -15.10[1] |
| NaCl | 29.70 | -20.56[1] | NH4Cl | 24.50 | -15.36[1] |
| NaCl | 30.4 | -21.12[1] | |||
| KCl | 7.09 | -3.07[1] | |||
| KCl | 10.77 | -4.66[1] | |||
| KCl | 17.38 | -7.51[1] | |||
| KCl | 22.69 | -9.84[1] | |||
| KCl | 23.80 | -10.34[1] | |||
| KCl | 24.60 | -10.66[1] |
乾冰溶劑冷卻浴[編輯]
乾冰即固體的二氧化碳有粒狀和棒狀的商品可供購買,它與多種溶劑都能形成有良好冷卻效果的混合物(詳見表2)。乾冰溶劑浴的配製和維持方法簡單可靠,一般是將粒狀的乾冰一顆顆的小心加入到所需溶劑中直至有包覆着凍結溶劑的乾冰塊出現為止,此時冷卻浴溫度已至所能達到的穩態溫度(Steady state temperature),之後只需每間隔一定時間補充塊狀乾冰並加以攪動就能保持溫度[3];且乾冰溶劑浴的溫度重現性較好,穩態溫度的變化能控制在±1℃的幅度內[3]。
溶劑純度對乾冰溶劑浴的影響較大。一個典型的例子就是使用分析純的乙腈調製的乾冰乙腈浴穩態溫度是-42°C,但當分析純的乙腈中混有0-3%的丙烯腈時冷卻浴的穩態溫度會從-42降至-51℃,而用工業級(Technical grade)乙腈調製的乾冰乙腈浴穩態溫度為-42℃且這個溫度效果是可重複的[3]。
| 溶劑 | 溫度(℃) | 溶劑 | 溶劑(℃) |
|---|---|---|---|
| 乙二醇 | -12[4] | 異丙醚 | -60 |
| 四氯化碳 | -23[3] | 氯仿 | -61[3] |
| 3-庚酮 | -38[3] | 乙醇 | -78[4] |
| 工業級乙腈 | -46[3] | 丙酮 | -78[3] |
| 分析純乙腈 | -42[3] |
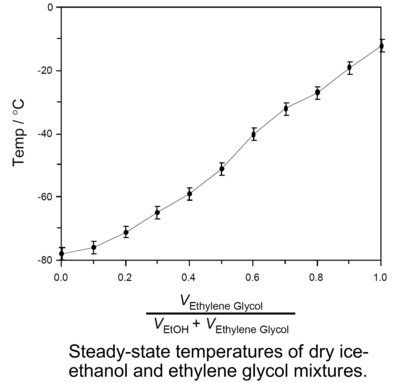
配製乾冰溶劑浴不僅可以使用單一的純溶劑,也可使用由兩種溶劑互溶後配製的混合溶劑,使用混合溶劑時可通過調節兩種溶劑的比例來調節所需乾冰溶劑浴的穩態溫度,比如純的鄰二甲苯由於熔點只有-26℃,所以與乾冰混合製成的冷卻浴穩態溫度為-26℃且呈粘稠的淤泥狀,但使用鄰二甲苯和間二甲苯的混合溶液製作的乾冰溶劑浴不僅粘度小,而且還可通過調節鄰二甲苯和間二甲苯的體積比來近似線性地調節冷卻浴的溫度(見左下圖),溫度的變化範圍從-26°C至-72℃[3];另一種可以使用的混合溶劑體系是由乙二醇和乙醇組成的,通過調節乙二醇和乙醇的比例能近似線性地調節溫度,配製的冷卻浴溫度變化範圍是從-12℃至-78 ℃(見右下圖),只需要定時補充部分乾冰它就能可靠地維持恆定溫度至多5小時[4]。

參考文獻[編輯]
- ^ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 1.15 1.16 1.17 1.18 1.19 1.20 1.21 1.22 1.23 1.24 1.25 1.26 1.27 1.28 1.29 1.30 Worth H. Rodebush. The Freezing points of concentrated solutions and the free energy of solution of salts. J. Am. Chem. Soc. 1918, 40 (8): 1204–1213 [2012-08-29]. doi:10.1021/ja02241a008. (原始內容存檔於2015-03-30).(英文)
- ^ Wilbam P. Bryan and Robert H. Byrne. A calcium chloride solution, dry-ice, low temperature bath. J. Chem. Educ. 1970, 47 (5): 361. doi:10.1021/ed047p361.(英文)
- ^ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 3.10 Alan M. Phipps and David N. Hume. General purpose low temperature dry-ice baths. J. Chem. Educ. 1968, 45 (10): 664. doi:10.1021/ed045p664.(英文)
- ^ 4.0 4.1 4.2 4.3 Craig M. Jensen and Do W. Lee. Dry-Ice Bath Based on Ethylene Glycol Mixtures. J. Chem. Educ. 2000, 77 (5): 629 [2012-08-26]. doi:10.1021/ed077p629. (原始內容存檔於2016-04-21).(英文)
- ^ Ronald C. Blatchley. The Joys of Liquid Nitrogen. J. Chem. Educ. 1997, 74 (6): 616. doi:10.1021/ed074p616.4.(英文)
- ^ William T. Nolan and Thaddeus J. Gish. The Joys of Liquid Nitrogen (the authors reply). J. Chem. Educ. 1997, 74 (6): 617. doi:10.1021/ed074p617.(英文)
- ^ 7.00 7.01 7.02 7.03 7.04 7.05 7.06 7.07 7.08 7.09 7.10 7.11 7.12 7.13 7.14 7.15 7.16 7.17 7.18 7.19 7.20 7.21 7.22 7.23 7.24 7.25 7.26 7.27 7.28 7.29 7.30 7.31 7.32 7.33 7.34 7.35 7.36 7.37 7.38 7.39 7.40 7.41 7.42 7.43 7.44 7.45 7.46 7.47 7.48 7.49 7.50 7.51 7.52 7.53 7.54 7.55 7.56 7.57 7.58 7.59 7.60 7.61 7.62 7.63 7.64 7.65 7.66 7.67 7.68 7.69 7.70 7.71 7.72 7.73 7.74 7.75 7.76 7.77 7.78 7.79 7.80 7.81 7.82 7.83 7.84 7.85 7.86 Roger E. Rondeau. Slush Baths.. J. Chem. Eng. Data. 1966, 11 (1): 124–124 [2012-08-26]. doi:10.1021/je60028a037. (原始內容存檔於2019-12-04).(英文)
- ^ 8.0 8.1 R. E. Rondeau , L. A. Harrah. Melting Point and Vapor Pressures of 3-Hexyne. J. Chem. Eng. Data. 1965, 10 (1): 84–85. doi:10.1021/je60024a031.(英文)
