烯醇矽醚

矽烯醇醚(Silyl enol ether),又稱烯醇矽醚,是烯醇醚中氧原子上的基團為矽基取代形成的一類化合物。烯醇矽醚是烯醇的穩定形式,熱穩定性較高,是有機合成中的重要中間體。
合成[編輯]
烯醇矽醚一般由用含矽-鹵鍵的化合物(如氯矽烷)與醛、酮在弱鹼存在下反應或捕獲醛、酮去質子化生成的烯醇負離子得到。[1][2]
1、使用 TMSCl/Et3N/DMF 體系製備:在 Et3N / DMF 體系中,用醛酮與 TMSCl 反應生成三甲矽烯醇醚。用叔丁基二甲基氯矽烷也可以得到相應的叔丁基二甲基矽基烯醇醚。
Si-O鍵鍵能很高,羰基化合物與三甲氯矽烷反應時,不需加入強鹼,羰基化合物中少量存在的烯醇式就可以與三甲基氯矽烷反應,而反應後只要用弱鹼如三乙胺處理,便可得到烯醇矽醚。[3]氯矽烷中的矽原子對氧有高度的親電性。該反應可能的機理有如下兩種:[3]

不對稱酮與三甲基矽基化合物作用時產生兩種烯醇矽醚的混合物,並以熱力學控制產物即較穩定的多取代烯烴為主要產物。對於有些酮類如樟腦就不能用三甲基氯矽烷,而需要採用三氟甲磺酸三甲矽基酯(CF3SO3SiMe3)作為生成烯醇矽醚的試劑。
2、使用強鹼/TMSCl 體系製備:用非親核性的強鹼如LDA或NaHMDS,與酮作用生成相應的烯醇負離子,並用 TMSCl 捕獲它,也可以製得烯醇矽醚。如果酮是不對稱酮,則主要生成動力學控制的產物。
例如,三甲矽烯醇醚可由三甲基氯矽烷與用LDA處理酮後產生的烯醇負離子作用得到:

3、金屬還原法:酯與金屬鈉、TMSCl 在甲苯中反應,生成酯的雙分子還原產物——烯二醇的雙矽醚,此雙矽醚又可在酸性條件下水解得到偶姻縮合產物:

此外也可以通過α,β-不飽和羰基化合物的1,4-矽氫化反應[4]


反應[編輯]
水解:生成相應的羰基化合物,矽基最終轉變為六甲基二矽氧烷:

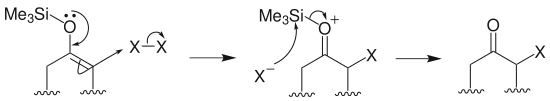
烷基化:烯醇矽醚在路易斯酸四氯化鈦存在下與叔鹵代烴或者酯類化學物反應,生成α-烴基酮:

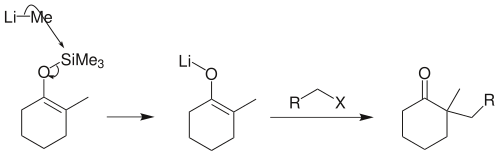
若反應物是伯鹵代烴,須先將烯醇矽醚轉化為烯醇負離子鋰鹽,才能順利地在α-位上發生烷基化:
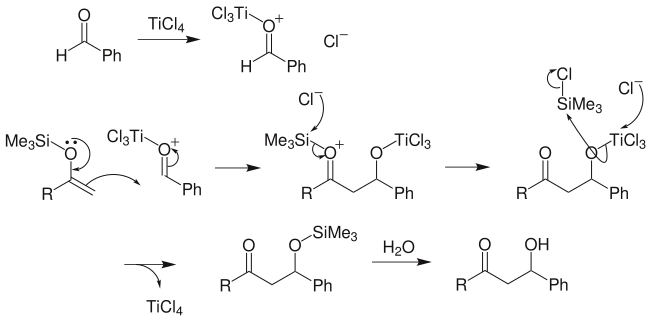
向山羥醛反應:先將某一酮製成三甲矽基烯醇醚,再與另一分子酮發生羥醛反應,可得到預期的β-羥基酮,並且避免了交叉縮合的眾多副產物的產生:
Diels-Alder反應:烯醇矽醚中的三甲基矽基的供電性有利於雙烯體的D-A反應。Danishefsky雙烯就是作為雙烯體參與D-A反應的烯醇矽醚的一個例子。
Rubottom氧化反應:被mCPBA氧化得到矽基保護的α-羥基酮:[7]

Saegusa氧化反應:某些烯醇矽醚被乙酸鈀(II)氧化為α,β-不飽和羰基化合物。

烯酮矽基縮酮[編輯]
烯酮矽基縮酮(Ketene silyl acetal)是一類有 R-C=C(OSiR3)(OR') 結構的烯醇矽醚,其親核性比普通的烯醇矽醚更強,可以較快地與α,β-不飽和羰基化合物起反應。
製備:

反應:
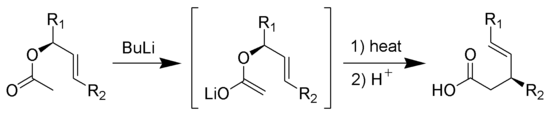
Ireland-Claisen重排反應:烯酮矽基縮酮發生[3,3]σ遷移反應重排,水解後得到γ,δ-不飽和羧酸:
參見[編輯]
參考資料[編輯]
- ^ Organic Syntheses, Coll. Vol. 9, p.564 (1998); Vol. 73, p.123 (1996) Article (頁面存檔備份,存於互聯網檔案館)
- ^ Organic Syntheses, Coll. Vol. 8, p.277 (1993); Vol. 66, p. 43 (1988) Article (頁面存檔備份,存於互聯網檔案館).
- ^ 3.0 3.1 J. P. Clayden, N. Greeves, S. G. Warren, P. D. Wothers (2000), Organic Chemistry (1st ed.), Oxford: Oxford University Press, p. 540, ISBN 978-0-19-850346-0
- ^ Masahiro Anada, Masahiko Tanaka, Kanami Suzuki, Hisanori Nambu, and Shunichi Hashimoto. Dirhodium(II) Tetrakis(perfluorobutyrate)-Catalyzed 1,4-Hydrosilylation of α,β-Unsaturated Carbonyl Compounds (PDF). Chem. Pharm. Bull. 2006, 54 (11): 1622–1623 [2022-01-12]. (原始內容存檔 (PDF)於2018-07-22).
- ^ R. Tong, F. E. McDonald, Angewandte Chemie, Int. Ed. 2008, 47, 1-4.
- ^ Organic Syntheses, Coll. Vol. 8, p.286 (1993); Vol. 69, p.129 (1990) Article (頁面存檔備份,存於互聯網檔案館)
- ^ Organic Syntheses, Coll. Vol. 7, p.282 (1990); Vol. 64, p.118 (1986) Article (頁面存檔備份,存於互聯網檔案館).
