3-苯並噁庚因
| 3-苯並噁庚因 | |
|---|---|
| |
| IUPAC名 3-Benzoxepine | |
| 別名 | 3-苯並氧雜䓬 3-苯並氧雜環庚三烯 |
| 識別 | |
| CAS號 | 264-13-1 |
| PubChem | 3659427 |
| ChemSpider | 2892804 |
| SMILES |
|
| InChI |
|
| InChIKey | APSZPCTXHHKIQO-UHFFFAOYSA-N |
| 性質 | |
| 化學式 | C10H8O |
| 摩爾質量 | 144.17 g·mol−1 |
| 外觀 | 黃色固體[1] |
| 熔點 | 84 |
| 溶解性 | 溶於非極性溶劑(乙醚、苯、四氯甲烷)[2]和醇類(甲醇)[3] |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
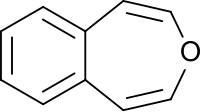
3-苯並噁庚因是具有芳香苯環和非芳香族、不飽和、含氧七元雜環氧雜環庚烷的環系。卡爾·迪姆羅特及其同事於1961年首次描述了合成方式。[1]它是苯並噁庚因的三種異構體之一。
發現與合成[編輯]
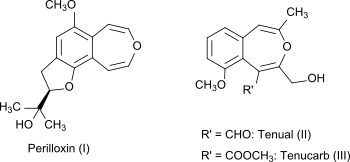
3-苯並噁庚因本身是一種非天然化合物,但其雙環系統可見於紫蘇(acuta變種)的天然化合物(如perilloxin)[4]和Asphodeline tenuior的天然化合物tenual和tenucarb。[5]Perilloxin可以抑制環氧合酶,IC50為23.2 μM。 [4]阿司匹林和布洛芬等非甾體抗炎藥也通過抑制環氧合酶家族發揮作用。[6]
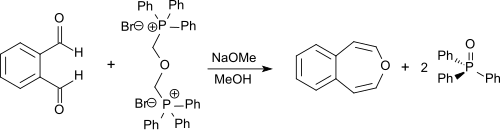
未取代的3-苯並噁庚因可以通過鄰苯二甲醛與雙-(α,α'-三苯基鏻)-二甲醚二溴化物的雙維蒂希反應合成。[3]後一種化合物可以由α,α'-二溴二甲醚(雙(溴甲基)醚或BBME)合成,α,α'-二溴二甲醚可從氫溴酸、多聚甲醛[7]和三苯基膦獲得。該反應在無水甲醇中與甲醇鈉進行,產物可獲得55%的收率。[1][2]
該化合物也可以通過紫外線照射某些萘衍生物(如1,4-環氧-1,4-二氫萘)來獲得。[8]
它也可以通過1,4-二氫萘的光氧化,然後對所形成的氫過氧化物進行熱裂解反應來獲得。[9]
後一種合成方式所得的3-苯並噁庚因收率較低(4%至6%)。[8]
參考資料[編輯]
- ^ 1.0 1.1 1.2 Dimroth, K.; Pohl, G. 3-Benzoxepin. Angew. Chem. 1961, 73 (12): 436. Bibcode:1961AngCh..73..436D. doi:10.1002/ange.19610731215.
- ^ 2.0 2.1 Rosowsky, A. (編). II. Oxepin Ring Systems Containing Two Rings. Seven-Membered Heterocyclic Compounds Containing Oxygen and Sulfur. The Chemistry of Heterocyclic Compounds 26th. New York: Wiley-Interscience. 1972: 96. ISBN 0-471-38210-8 (German).
- ^ 3.0 3.1 引用錯誤:沒有為名為
Pohl的參考文獻提供內容 - ^ 4.0 4.1 Liu, J.-H.; Steigel, A.; Reininger, E.; Bauer, R. Two new prenylated 3-benzoxepin derivatives as cyclooxygenase inhibitors from Perilla frutescens var. acuta. J. Nat. Prod. 2000, 63 (3): 403–405. PMID 10757731. doi:10.1021/np990362o.
- ^ Ulubelen, A.; Tuzlaci, E.; Atilan, N. Oxepine derivatives and anthraquinones from Asphodeline tenuior and A. taurica. Phytochemistry. 1989, 28 (2): 649–650. Bibcode:1989PChem..28..649U. doi:10.1016/0031-9422(89)80076-7.
- ^ Kester, M.; Karpa, K. D.; Vrana, K. E. NSAIDs. Pharmacology. Elsevier's Integrated Review. Elsevier Health Sciences. 2011: 165–166. ISBN 9780323074452.
- ^ US patent 20040242799,Grabarnick, M. & Sasson, Y.,「Process to bromomethylate aromatic compounds」,發表於2004-12-02,指定於Grabarnick, M.和Sasson, Y.
- ^ 8.0 8.1 Ziegler, G. R. Mechanisms of photochemical reactions in solution. LVII. Photorearrangement of 1,4-epoxy-1,4-dihydronaphthalene to benz[f]oxepin. J. Am. Chem. Soc. 1969, 91 (2): 446–449. doi:10.1021/ja01030a040.
- ^ Jeffrey, A. M.; Jerina, D. M. Autoxidation of 1,4-dihydronaphthalene. Formation of 3-benzoxepin via pyrolysis of 2-hydroperoxy-1,2-dihydronaphthalene. J. Am. Chem. Soc. 1972, 94 (11): 4048–4049. doi:10.1021/ja00766a084.