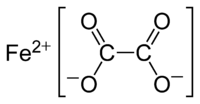
草酸亞鐵
| 草酸亞鐵 | |
|---|---|

| |
| |
| 英文名 | Ferrous oxalate Iron(II) oxalate |
| 別名 | 草酸鐵(II) |
| 識別 | |
| CAS號 | 516-03-0 6047-25-2((dihydrate)) |
| PubChem | 10589 |
| SMILES |
|
| EINECS | 208-217-4 |
| 性質 | |
| 化學式 | FeC2O4 |
| 莫耳質量 | 143.86 g/mol(無水) 179.89 g/mol(二水) g·mol⁻¹ |
| 外觀 | 黃色晶體(二水)[1] |
| 氣味 | 無味 |
| 密度 | 2.28 g·cm-3 |
| 熔點 | 200-275℃(無水,分解) 120-170℃(二水,失水) |
| 溶解性(水) | 0.097 g/100ml(二水,25℃) |
| 危險性 | |
| 警示術語 | R:R21/22 |
| 安全術語 | S:S24/25 |
| 歐盟分類 | |
GHS危險性符號 [2] [2]
| |
| GHS提示詞 | Warning |
| H-術語 | H302, H312[2] |
| P-術語 | P280[2] |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
草酸亞鐵(化學式:FeC2O4)是鐵(II)的草酸鹽,黃色晶體,難溶於水,緩慢溶於濃鹽酸。[3]
製備[編輯]
草酸亞鐵可由Fe2+與C2O42-在溶液中的反應製得:[4]
- Fe2+ + C2O42- → FeC2O4↓
如將硫酸酸化的硫酸亞鐵銨和草酸溶液混合,加熱並攪拌,靜置後倒出上層清液,分別用蒸餾水和丙酮洗滌沉澱,乾燥,得到草酸亞鐵二水合物晶體。[5]
化學性質[編輯]
草酸亞鐵可溶於鹼金屬草酸鹽溶液中,形成[Fe(C2O4)2]2-。[4]
加熱草酸亞鐵固體,可以得到奈米鐵粉。該粉末可以在空氣中自燃。[6]
- FeC2O4 → Fe + 2 CO2↑
加熱草酸亞鐵二水合物,其分解反應分為三步,首先是結晶水的脫除:[1]
- FeC2O4·2H2O → FeC2O4 + 2 H2O
第二步是脫去CO:
- FeC2O4 → FeCO3 + CO↑
第三步是FeCO3的分解:
- FeCO3 → FeO + CO2↑
此外,當H2O來不及擴散時,存在以下副反應:
- 3 FeO + H2O → Fe3O4 + H2
用途[編輯]
參考文獻[編輯]
- ^ 1.0 1.1 方正東, 汪敦佳. 二水草酸亞鐵熱分解行為及脫水反應動力學研究 (頁面存檔備份,存於網際網路檔案館). 無機化學學報, 2005, 21(11):1682-1686
- ^ 2.0 2.1 2.2 來源:Sigma-Aldrich Co., Iron(II) oxalate dihydrate (2014-05-03查閱).
- ^ 朱文祥. 無機化合物製備手冊. 化學工業出版社, 2006. pp 516
- ^ 4.0 4.1 謝高陽 等. 無機化學叢書 第九卷 錳分族 鐵系 鉑系. 科學出版社, 2011. pp 173 羧酸鐵(II)
- ^ 5.0 5.1 孫悅, 喬慶東. 合成草酸亞鐵的反應時間對組成的影響. 遼寧石油化工大學學報, 2005, 25(4):1-4
- ^ 趙維元. 奈米鐵粉的製備及應用研究. 高中數理化, 2015(16): 61-62
- ^ Andre AngermannJörg Töpfer. Synthesis of magnetite nanoparticles by thermal decomposition of ferrous oxalate dihydrate. J. J Mater Sci (2008) 43: 5123. doi:10.1007/s10853-008-2738-3
- ^ Xiangqian Fan, et al. α-Ferrous oxalate dihydrate: a simple coordination polymer featuring photocatalytic and photo-initiated Fenton oxidations. Sci China Mater 2016, 59(7): 574–580
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
