氫氧化鋇
| 氫氧化鋇 | |
|---|---|

| |

| |
| 識別 | |
| CAS號 | 17194-00-2 22326-55-2(一水合物) 12230-71-6(八水合物) |
| PubChem | 28387 |
| ChemSpider | 26408 |
| SMILES |
|
| InChI |
|
| InChIKey | RQPZNWPYLFFXCP-NUQVWONBAR |
| Gmelin | 846955 |
| ChEBI | 32592 |
| RTECS | CQ9200000 |
| 性質 | |
| 化學式 | Ba(OH)2 |
| 摩爾質量 | 171.342 g/mol(無水) 189.36 g/mol(一水合物) 315.46 g/mol(八水合物) g·mol⁻¹ |
| 外觀 | 白色固體 |
| 熔點 | 78 °C(八水合物) >408 °C(無水) |
| 沸點 | 780 °C |
| 溶解性(水) | 5.6 g/100 g(八水合物) |
| 溶解性(其它溶劑) | 微溶 |
| pKb | 0.15 (第一個 OH−), 0.64 (第二個 OH−) [1] |
| 結構 | |
| 晶體結構 | 八面體 |
| 熱力學 | |
| ΔfHm⦵298K | −944.7 kJ/mol |
| 危險性 | |
| 歐盟危險性符號 | |
| 警示術語 | R:R35-R37/38 |
| 安全術語 | S:S2-S28 |
| NFPA 704 | |
| 閃點 | 不可燃 |
| 相關物質 | |
| 其他陰離子 | 氧化鋇、過氧化鋇 |
| 其他陽離子 | 氫氧化鈣、氫氧化鍶 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
氫氧化鋇是鋇的氫氧化物,分子式為Ba(OH)2,為白色顆粒狀固體。
用途[編輯]
工業上,氫氧化鋇是其它鋇化合物的前體。它的一水合物可用來脫水和在產品中移除硫酸鹽。[2]該應用利用了硫酸鋇極低的溶解度。這種工業應用也適用於實驗室用途。
實驗室用處[編輯]
氫氧化鋇在分析化學中用於滴定弱酸,特別是有機酸。它與氫氧化鈉和氫氧化鉀不同,其水溶液不含碳酸鹽,因為碳酸鋇不溶於水。這使得例如酚酞或百里酚酞(具有鹼性顏色變化)的指示劑不會因碳酸根離子的存在而導致滴定錯誤。[3]
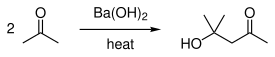
氫氧化鋇偶爾在有機合成中用作強鹼,例如水解酯[4]和腈[5][6][7],也在羥醛縮合中作為鹼。
它可用於水解十一烷二酸二甲酯中,兩個等價的甲酯基團之一。[8]
氫氧化鋇也用於氨基酸的脫羧,並釋放碳酸鋇。[9]
製備和結構[編輯]
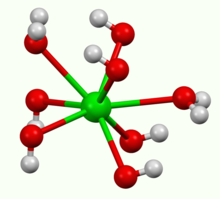
反應產生的是八水合物,它在空氣中加熱時失水成一水合物。在 100 °C 的真空下,一水合物直接分解成 BaO 和水。[12]一水合物是層狀結構的(見上圖)。Ba2+ 中心為四方反稜柱結構,每個Ba2+ 中心都被兩個水配體和六個氫氧根配體包圍,而它們分別被兩個和三個 Ba2+包圍。[13]在八水合物中, Ba2+中心是八配位的,不共享配體。[14]
反應[編輯]
氫氧化鋇在 800 °C以上分解成氧化鋇。它和二氧化碳反應,形成碳酸鋇。氫氧化鋇水溶液是強鹼性的,會和酸中和。因此,它分別和硫酸和磷酸反應,形成硫酸鋇和磷酸鋇。氫氧化鋇和硫化氫反應,形成硫化鋇。當氫氧化鋇水溶液與其它金屬鹽溶液混合時,會產生不溶性或難溶性鋇鹽的沉澱,可能是由置換反應引起的。[15]
氫氧化鋇和銨鹽的反應是強吸熱過程。八水合氫氧化鋇和氯化銨[16][17] 或硫氰酸銨[18][19] 的反應通常用作課堂化學演示,會產生足夠冷的溫度以凍結水。
危險性[編輯]
參考資料[編輯]
- ^ Sortierte Liste: pKb-Werte, nach Ordnungszahl sortiert. – Das Periodensystem online. [2019-01-15]. (原始內容存檔於2018-11-16).
- ^ Robert Kresse, Ulrich Baudis, Paul Jäger, H. Hermann Riechers, Heinz Wagner, Jochen Winkler, Hans Uwe Wolf, "Barium and Barium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2007 Wiley-VCH, Weinheim. doi:10.1002/14356007.a03_325.pub2
- ^ Template:VogelQuantitative
- ^ Meyer, K.; Bloch, H. S. (1945). "Naphthoresorcinol (頁面存檔備份,存於網際網路檔案館)". Org. Synth. 25: 73; Coll. Vol. 3: 637.
- ^ Brown, G. B. (1946). "Methylsuccinic acid (頁面存檔備份,存於網際網路檔案館)". Org. Synth. 26: 54; Coll. Vol. 3: 615.
- ^ Ford, Jared H. (1947). "β-Alanine (頁面存檔備份,存於網際網路檔案館)". Org. Synth. 27: 1; Coll. Vol. 3: 34.
- ^ Anslow, W. K.; King, H.; Orten, J. M.; Hill, R. M. (1925). "Glycine (頁面存檔備份,存於網際網路檔案館)". Org. Synth. 4: 31; Coll. Vol. 1: 298.
- ^ Durham, L. J.; McLeod, D. J.; Cason, J. (1958). "Methyl hydrogen hendecanedioate (頁面存檔備份,存於網際網路檔案館)". Org. Synth. 38:55; Coll. Vol. 4:635.
- ^ 存档副本. [2021-07-14]. (原始內容存檔於2021-07-14).
- ^ Thorpe, J. F.; Kon, G. A. R. (1925). "Cyclopentanone (頁面存檔備份,存於網際網路檔案館)". Org. Synth. 5: 37; Coll. Vol. 1: 192.
- ^ Conant, J. B.; Tuttle, Niel. (1921). "Diacetone alcohol (頁面存檔備份,存於網際網路檔案館)". Org. Synth. 1: 45; Coll. Vol. 1: 199.
- ^ (1960). Gmelins Handbuch der anorganischen Chemie (8. Aufl.), Weinheim: Verlag Chemie, p. 289.
- ^ Kuske, P.; Engelen, B.; Henning, J.; Lutz, H.D.; Fuess, H.; Gregson, D. "Neutron diffraction study of Sr(OH)2(H2O) and beta-Ba(OH)2*(H2O)" Zeitschrift für Kristallographie (1979-2010) 1988, vol. 183, p319-p325.
- ^ Manohar, H.; Ramaseshan, S. "The crystal structure of barium hydroxide octahydrate Ba (OH)2(H2O)8" Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie 1964. vol. 119, p357-p374
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Endothermic Reactions of Hydrated Barium Hydroxide and Ammonium Chloride. UC San Diego. [2 April 2014]. (原始內容存檔於2021-01-15).
- ^ Endothermic Solid-Solid Reactions. [2021-07-14]. (原始內容存檔於2016-07-14).
- ^ Camp, Eric. Endothermic Reaction. Univertist of Washington. [2 April 2014]. (原始內容存檔於2020-01-10).
- ^ Endothermic solid-solid reactions (PDF). Classic Chemistry Demonstrations. The Royal Society of Chemistry. [2 April 2014]. (原始內容 (PDF)存檔於7 April 2014).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||